编辑:生活网 来源:生活网
![]()
ER+/HER2-乳腺癌是最常见的乳腺癌亚型,高危疾病的特征是分期更高、更年轻、3级、高危基因组检测和低ER表达(1%~10%)。高危早期ER+/HER2-乳腺癌的治疗方法包罗新辅助化疗(NACT)、辅助内分泌治疗(ET)和辅助阿贝西利治疗等,2023年欧洲肿瘤内科学会(ESMO)大会和刚刚结束的圣安东尼乳腺癌研讨会(SABCS)上,免疫治疗在该类乳腺癌中的研究有了突破性进展,《医师报》特邀广东省人民医院乳腺科李学瑞教授为各人分享。
Ⅲ期研究突破性进展令人欣喜
高危ER+/HER2-早期乳腺癌患者遇见曙光
2023年欧洲肿瘤内科学会(ESMO)大会和刚刚结束的圣安东尼乳腺癌研讨会(SABCS)上,对于高危ER+/HER2-早期乳腺癌,两项Ⅲ期研究结果令人瞩目,一项是纳武利尤单抗的CheckMate 7FL研究[1-2],另一项是帕博利珠单抗的KEYNOTE-756研究[3-4]。
CheckMate 7FL研究是一项随机、多中心、双盲、慰藉剂对照的Ⅲ期临床研究,旨在评估纳武利尤单抗(NIVO)+NACT和辅助ET(紫杉醇加环磷酰胺)在高危ER+/HER2-乳腺癌中的疗效。主要终点为修正意向治疗人群(mITT)的病理完全缓解(pCR)(ypT0/Tis,ypN0);次要终点包罗PD-L1阳性(SP142≥1%)患者的pCR、残余肿瘤负荷(RCB)0-1率(所有患者或PD-L1阳性患者)、宁静性等;探索性终点为无事件生存期(EFS)。
2023年ESMO大会报道的主要终点pCR和整体人群、PD-L1阳性人群的RCB 0-1率,结果显示NIVO+NACT组的pCR率显著高于慰藉剂+NACT组(24.5% vs. 13.8%,OR=2.05,P=0.0021)(图1),RCB 0-1比例也提高了9.2%,且PD-L1 IC ≥1%患者中NIVO组获益更大,NIVO+NACT的宁静性与已知各药物的宁静性一致,未发现新发宁静性信号。
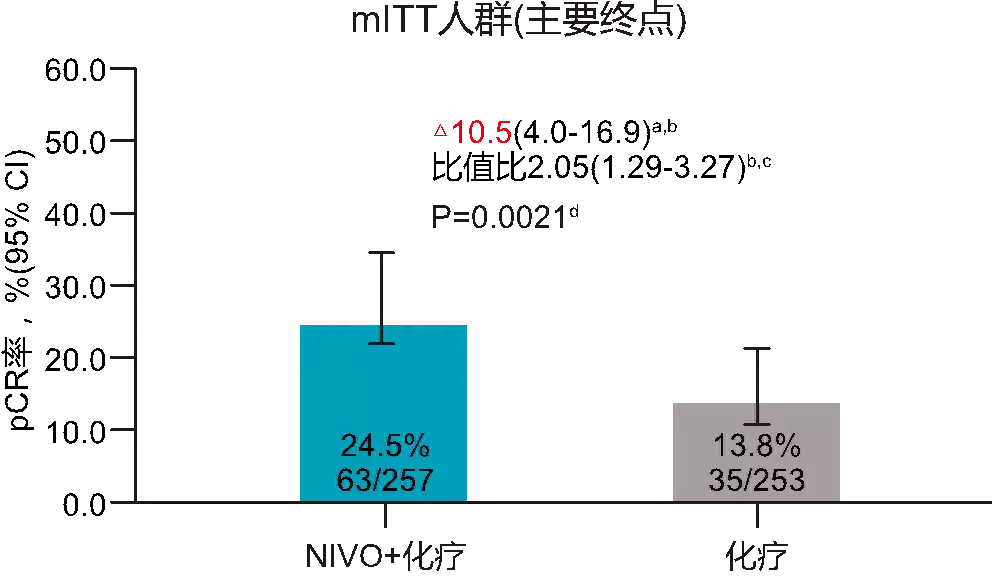
图1 CheckMate 7FL研究中mITT人群的pCR率
该研究以联合阳性评分(CPS)算法评估PD-L1基线表达水平,2023年SABCS会议更新相应生物标记物数据结果,研究显示CPS≥1的患者中pCR率(NIVO组和慰藉剂组之间的未加权率差别)为16.6%,CPS≥10的患者中为32.4%,CPS≥20的患者中为52.3%。在mITT人群中,两组的∆pCR率为10.7%,CPS
KEYNOTE-756研究是一项针对高风险ER+/HER2早期乳腺癌在新辅助及辅助治疗阶段加入免疫治疗后的疗效评估,其主要终点为pCR(ypT0/Tis,ypN0)和EFS,旨在评估帕博利珠单抗/慰藉剂+化疗新辅助治疗,序贯帕博利珠单抗/慰藉剂+ET辅助治疗高危ER+/HER2-早期乳腺癌的疗效和宁静性。2023年ESMO大会对pCR的数据进行了报道,结果显示,帕博利珠单抗+化疗组的pCR率(ypT0/Tis,ypN0)较慰藉剂+化疗组显著提高8.5%,为24.3% vs 15.6%(P=0.00005)(图2)。所有预设亚组均能从帕博利珠单抗+化疗中获得pCR率获益,尤其是在ER低表达(<10%)患者中,pCR率显著提高。宁静性与各药物已知的特征一致,未见宁静性信号。研究将继续评估另一个双重主要终点EFS。
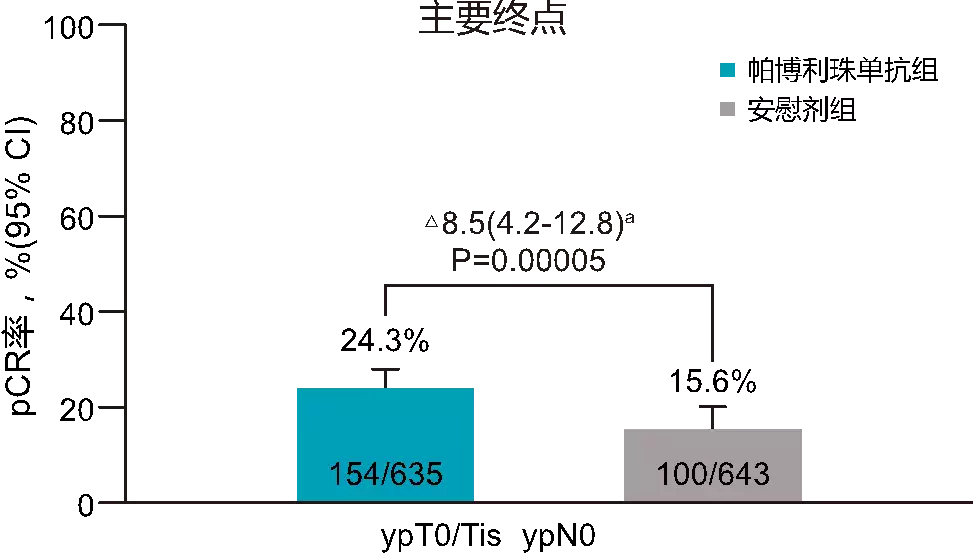
图2 KEYNOTE-756研究中两组的pCR率
两项研究显示免疫治疗可显著改善ER+/HER2-乳腺癌的pCR率,均达24%左右,有利于提高临床治疗的预后。根据PD-L1状态分析的pCR结果显示,CheckMate 7FL研究中有34%的ER+肿瘤PD-L1为阳性,NIVO组PD-L1阳性和阴性患者的pCR率较对照组分别提高24.1%和3.6%;KEYNOTE-756研究中有75%的ER+肿瘤PD-L1为阳性,帕博利珠单抗组PD-L1阳性和阴性患者的pCR率较对照组分别提高9.8%和4.5%,证实PD-L1既是预后因素,也是预测因素,PD-L1阳性pCR率获益更大。此种pCR改善能否转为EFS获益未来仍有待进一步深入研究,其过渡为辅助治疗仍需开展大量临床研究以提供疗效和宁静性支持。
CDK4/6抑制剂联合免疫治疗可行性仍需探索,排兵布阵提供个体化治疗方案
目前,CDK4/6抑制剂联合ET是ER+/HER2-晚期乳腺癌患者高效的治疗选择,已经广泛应用于晚期乳腺癌和高危复发风险的早期乳腺癌术后辅助治疗中。正如前两项研究所展示,免疫治疗正成为当前肿瘤治疗中的热点话题,对于ER+/HER2-患者,CDK4/6抑制剂联合免疫治疗能否可行始终是临床不停探索的问题。
CDK4/6抑制剂联合免疫治疗毒副作用较大,易产生较多不良事件,影响治疗宁静性,暂不推荐应用,且约50%的ER+乳腺癌术后5年才出现复发,长疗程或者后期给予CDK4/6抑制剂治疗更为合理。总体而言,CDK4/6抑制剂显著改善了晚期/转移性ER+/HER2-乳腺癌患者生存时间,但在辅助治疗的临床实验中体现不一,临床使用时应结合患者个体情况综合考虑使用,选择有询证医学证据的药物进行治疗。
目前临床对于ER+/HER2-乳腺癌患者用药的排兵布阵主要先选择化疗获选择继续ET同时联合CDK4/6抑制剂,从而减轻毒副作用,提高临床疗效,保障患者获益。未来仍需设计相关研究,开展大型临床试验,为HR+/Her2-的患者合理使用免疫治疗提供循证依据。
国产PD-1抑制剂进展如火如荼,破局“平替“之路道阻且长
PD-1抑制剂作为一种重要的免疫疗法已在全球范围内广泛应用,国产PD-1目前已有近10种上市,是否可以“平替“成为当前讨论热点。首先,PD-1抑制剂是一种能够激活免疫系统,攻击肿瘤细胞的药品,通过识别并抑制T细胞上的免疫抑制分子,使T细胞可攻击肿瘤细胞。国产PD-1上市价格相对海外同类产物更为亲民,且部门产物的有效性并不逊色于进口产物,为我国广大的肿瘤患者带来了治疗新希望。
尽管“平替“是一个值得期待的方向,但免疫抑制剂的替代仍需慎重,其并非单纯完全仿照即可达相同疗效,仍需要考虑副作用。即使其发生概率很低,一旦发生将会对患者产生严重后果,影响疗效及预后。临床选择PD-1抑制剂时应重点关注获益风险比,为患者提供最大获益。当前国产PD-1仍任重道远,需要在药物剂型、给药方式、生产工艺等方面进行创新,提高患者的用药体验,降低药物的不良反应,走出一条属于自己的门路。
李学瑞教授总结:
当前研究表明,免疫治疗在ER+/HER2-乳腺癌新辅助治疗中展现出显著疗效,尤其在PD-L1阳性乳腺癌患者中,别的其在乳腺癌的辅助治疗方面具有潜在适用性,但其能否进一步改善患者的远期疗效(DFS、OS)仍需更多的临床研究数据。当前国产PD-1抑制剂研发如火如荼,未来仍需继续创新造福更多肿瘤患者。
李学瑞教授
简历

李学瑞 教授
医学博士 主任医师
广东省人民医院乳腺科行政副主任
广东省保健协会乳腺保健分会副主任委员
广州市医学会乳腺病学分会青年学组组长
广东省医学会乳腺病学会常务委员
广东省胸部肿瘤协会乳腺癌专业委员会常务委员
广东省中医药学会乳腺病专业委员会常务委员
广东省抗癌协会乳腺癌专业委员会委员
广州市抗癌协会执行委员会委员
研究方向:乳腺癌外科为主的综合治疗、乳房重建、保乳术中放疗临床及基础研究。
参考文献(向上滑动检察):
[1] S. Loi, G. Curigliano, R.F. Salgado, et al. A randomized, double-blind trial of nivolumab (NIVO) vs placebo (PBO) with neoadjuvant chemotherapy (NACT) followed by adjuvant endocrine therapy (ET) ± NIVO in patients (pts) with high-risk, ER+ HER2L primary breast cancer (BC). 2023 ESMO. LBA20.
[2] Giuseppe Curigliano, et al. Biomarker Results in High-risk Estrogen Receptor Positive, Human Epidermal Growth Factor Receptor 2 Negative Primary Breast Cancer Following Neoadjuvant Chemotherapy ± Nivolumab: an Exploratory Analysis of CheckMate 7FL. 2023 SABCS abstract #GS01-01.
[3] F. Cardoso, H.L. McArthur, P. Schmid, et al. KEYNOTE-756: Phase III study of neoadjuvant pembrolizumab (pembro) or placebo (pbo) + chemotherapy (chemo), followed by adjuvant pembro or pbo + endocrine therapy (ET) for early-stage high-risk ER+/HER2e breast cancer. 2023 ESMO. LBA21.
[4] Fatima Cardoso, et al. Phase 3 study of neoadjuvant pembrolizumab or placebo plus chemotherapy, followed by adjuvant pembrolizumab or placebo plus endocrine therapy for early-stage high-risk ER+/HER2− breast cancer: KEYNOTE-756. 2023 SABCS GS01-02.