编辑:财经网 来源:财经网
![]()
MRD具有微小残留病灶(minimal residual disease)、可丈量残留病灶(measurable residual disease)、分子残留病灶(molecular residual disease)等多重定义,指治疗后仍存在于患者体内、通例影像学方法无法检出的残留微小病灶,这些残留微小病灶可能导致未来肿瘤进展或复发转移。MRD最初应用于血液系统恶性肿瘤,作为生物标记物以判断患者预后。近年来基于ctDNA检测技术的MRD证据不停积累,MRD概念已逐渐走入实体瘤的临床实践[1]。本期《医师报》特别邀请到陕西省人民医院肿瘤病院肿瘤内科白俊教授来为我们介绍MRD在实体瘤精准诊疗中的应用、研究进展及未来展望。
珠联璧合,固定化panel联合个性化探针提升MRD检测灵敏度
在cfDNA(circulating cell-free DNA)中检测带有突变的ctDNA(circulating tumor DNA)是实体瘤MRD检测的主要手段。ctDNA在早期实体瘤患者外周血中含量低、突变丰度低、突变异质性高,作为MRD检测手段需要极高的灵敏度[2]。增加检测位点数量、提高测序深度或加大cfDNA输入均可提高ctDNA-MRD检测灵敏度。
检测位点的选择可以基于患者原发组织样本的突变(tumor-informed assays),也可使用预先设计好的固定化的驱动基因panel(tumor-naïve assays)[3],前者灵敏度和特异度更好,后者可覆盖异质性和进化突变。
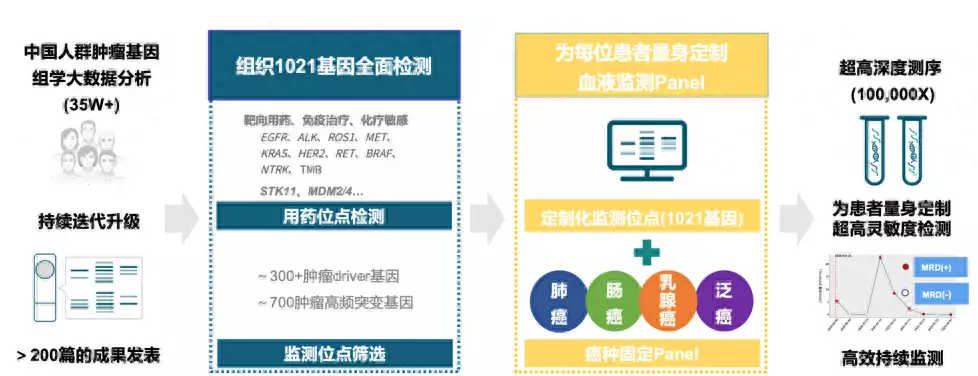
图1固定化panel联合个性化探针定制MRD监测方案
图1固定化panel联合个性化探针定制MRD监测方案
最近,由广东省临床试验协会申请的CTONG2201临床试验便取长补短,联合tumor-informed个体化探针和tumor-naïve癌肿核心panel的方法来探索NSCLC术后MRD监测计谋。该方法基于中国人群肿瘤基因组学大数据分析,对患者样本的基因突变进行全面检测,结合癌种固定panel为患者量身定制血液监测panel,精准化监测位点以提供超高深度测序,兼得二者优点。
逐步全能,MRD检测贯通实体瘤各分期全病程
MRD在实体瘤的各分期全病程中体现其应用价值前景。
MRD可预测实体瘤新辅助治疗的疗效。一项针对NSCLC可手术患者新辅助治疗方案的随机对照试验[4]结果显示,在干预组和对照组中,ctDNA清除组的无事件发生率(EFS)均显著长于未清除组,ctDNA清除组的病理完全缓解率(pCR)更高,提示ctDNA清除可作为预测新辅助治疗的疗效指标。
MRD可预测实体瘤患者是否能从术后辅助治疗中获益。一项meta分析[5]结果显示,术前、术后和化疗后的MRD阳性状态与NSCLC患者较差的无复发生存时间(RFS)密切相关。
辅助治疗显著改善MRD阳性患者的RFS,但在MRD阴性患者中呈相反趋势。另一项研究[6]结果也显示NSCLC患者中动态监测MRD的阴性预测价值可达96.8%,定义了潜在治愈人群,提示MRD阴性患者可能不能从辅助治疗中获益。
MRD也是手术后的独立预后因素,可监测术后复发。多项研究[7-10]证实,术后MRD阳性NSCLC患者的预后显著差于阴性患者。MRD连续检测可早于影像学发现结直肠癌患者术后复发[11]。
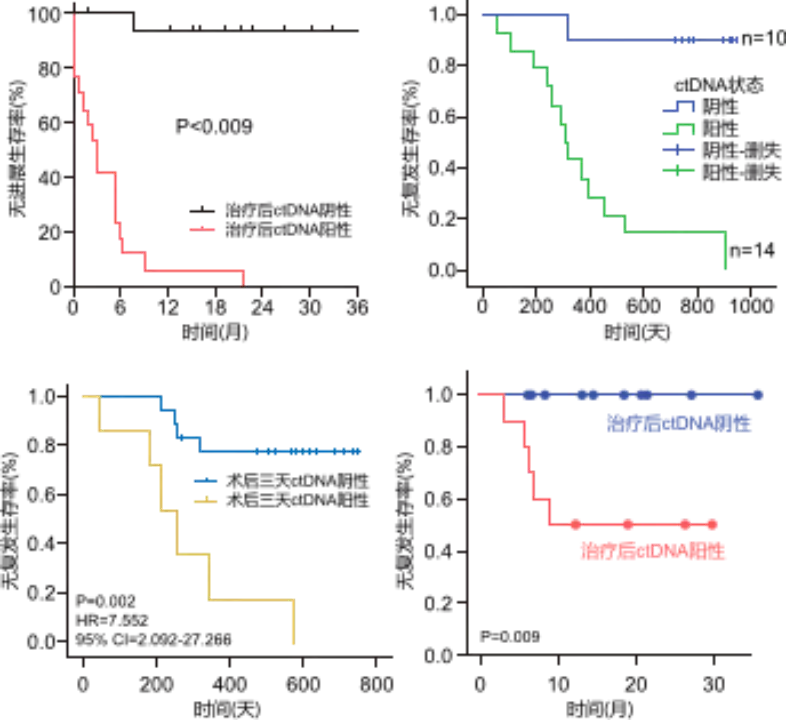
图3 NSCLC患者术后MRD状态对结局的影响[7-10]
对于不可手术的晚期NSCLC患者,MRD也可用于免疫治疗、靶向治疗疗效的早期评估,其预测恒久生存获益的效力优于RECIST尺度[12]。
ctDNA-MRD正逐步贯穿实体瘤各分期全病程,提示患者预后,预测治疗获益,助力精准治疗。
知行合一,干预性临床试验助力MRD改写实体瘤治疗结局
多项研究[5-10]已证实,实体瘤术后MRD阳性患者预后更差,易复发,对辅助治疗受益更大。如何结合ctDNA-MRD状态对实体瘤患者行进一步危险分层、实施差别的干预手段,如何精准治疗以减少过度治疗、提升患者整体生存获益,成为研究热点。
DYNAMIC研究是一项基于ctDNA-MRD状态对患者进行辅助治疗干预的随机多中心临床研究,旨在验证MRD的预测价值,其结果显示,对于Ⅱ期肠癌患者,通过ctDNA-MRD状态进行辅助治疗决策的患者预后与尺度治疗组无区别。
两组无复发生存率(RFS)无显著差别,ctDNA-MRD指导治疗组中阳性患者与阴性患者预后无显著差别,为通过MRD状态进行辅助治疗决策提供了有力的临床证据,对于MRD阴性的患者制止过度治疗,提高生活质量;对于MRD阳性的患者有的放矢,提高治愈率。
别的,探索全身治疗后MRD状态对于方案调整的指导意义、根据MRD筛选新辅助治疗可能的受益人群、结合MRD建立风险预测模型对患者进行分层,都是未来潜在的干预性研究方向。干预性临床试验大大提升MRD在临床精准诊疗中的实践意义,为提高实体瘤患者整体生存获益做出贡献。
白俊教授总结
MRD从血液肿瘤领域的成熟运用,到实体瘤领域临床实践落地,预后价值正在逐步走向预测价值,贯穿肿瘤各分期全病程。陪同着多项干预性临床试验的开展,在未来以MRD为结果的精准诊疗,有望改写肿瘤治疗结局,给患者带来极大的生存获益。
专家简介
陕西省人民医院肿瘤病院副院长,肿瘤内科主任
李嘉诚基金会陕西省人民医院宁养院主任
中国康复技术转化及发展促进会精准医学与肿瘤康复专业委员会 常委
陕西省医学会肿瘤医学分会化疗专业委员会 副主任委员
陕西省抗癌协会肿瘤生物治疗专业委员会 副主任委员
陕西省抗癌协会第一、二、三届抗癌药物专业委员会 副主任委员
陕西省药理学会第二届化疗药物专业委员会 副主任委员
陕西省保健协会肝脏疾病防治专业委员会 副主任委员
陕西省抗癌协会第四届肿瘤转移转移委员会 副主任委员
2007-2008年度在中国医学科学院/协和医科大学肿瘤医院/中国国家肿瘤研究所作为中组部“西部之光”访问学者,2016年5月赴美国到场“第一期哈佛大学肿瘤科主任研修班”并结业;2018年5月赴美国纽约哥伦比亚大学医学中心肿瘤中心进修学习三个月;
作为主要技术骨干到场国家“973”重大科研项目及多项国家自然科学基金、 教育部骨干教师资助项目、陕西省自然科学基金等多项课题。发表论文十余篇,其中SCI8篇,参编专著五部
参考文献:(滑动检察)
[1] Moding EJ, Nabet BY, Alizadeh AA, et al. Detecting Liquid Remnants of Solid Tumors: Circulating Tumor DNA Minimal Residual Disease. Cancer Discov. 2021;11(12):2968-2986.
[2] Parsons HA, Rhoades J, Reed SC, et al. Sensitive Detection of Minimal Residual Disease in Patients Treated for Early-Stage Breast Cancer. Clin Cancer Res. 2020;26(11):2556-2564.
[3] Santonja A, Cooper WN, Eldridge MD, et al. Comparison of tumor-informed and tumor-naïve sequencing assays for ctDNA detection in breast cancer. EMBO Mol Med. 2023;15(6):e16505.
[4] Forde PM, Spicer J, Lu S, et al. Neoadjuvant Nivolumab plus Chemotherapy in Resectable Lung Cancer. N Engl J Med. 2022;386(21):1973-1985.
[5] Shen H, Jin Y, Zhao H, et al. Potential clinical utility of liquid biopsy in early-stage non-small cell lung cancer. BMC Med. 2022;20(1):480. Published 2022 Dec 14.
[6] Zhang JT, Liu SY, Gao W, et al. Longitudinal Undetectable Molecular Residual Disease Defines Potentially Cured Population in Localized Non-Small Cell Lung Cancer. Cancer Discov. 2022;12(7):1690-1701.
[7] Chaudhuri AA, Chabon JJ, Lovejoy AF, et al. Early Detection of Molecular Residual Disease in Localized Lung Cancer by Circulating Tumor DNA Profiling. Cancer Discov. 2017;7(12):1394-1403.
[8] Abbosh C, Birkbak NJ, Wilson GA, et al. Phylogenetic ctDNA analysis depicts early-stage lung cancer evolution [published correction appears in Nature. 2017 Dec 20;:]. Nature. 2017;545(7655):446-451.
[9] Chen K, Zhao H, Shi Y, et al. Perioperative Dynamic Changes in Circulating Tumor DNA in Patients with Lung Cancer (DYNAMIC). Clin Cancer Res. 2019;25(23):7058-7067.
[10] Zviran A, Schulman RC, Shah M, et al. Genome-wide cell-free DNA mutational integration enables ultra-sensitive cancer monitoring. Nat Med. 2020;26(7):1114-1124.
[11] Reinert T, Henriksen TV, Christensen E, et al. Analysis of Plasma Cell-Free DNA by Ultradeep Sequencing in Patients With Stages I to III Colorectal Cancer [published correction appears in JAMA Oncol. 2019 Jun 13;:]. JAMA Oncol. 2019;5(8):1124-1131.
[12] Kansara M, Bhardwaj N, Thavaneswaran S, et al. Early circulating tumor DNA dynamics as a pan-tumor biomarker for long-term clinical outcome in patients treated with durvalumab and tremelimumab. Mol Oncol. 2023;17(2):298-311.